

柔性电子内窥镜凝聚了三十多年来固态成像和机械设计领域的改进成果。目前市面上有多种型号,每种型号都略有不同,并针对其所设计的胃肠道部位进行了优化。尽管有人提出了内窥镜控制部分的替代设计(例如“手枪式握把”),但自柔性内窥镜问世以来,其基本形状和布局基本保持不变。所有柔性电子内窥镜的基本组件和控制装置都非常相似(图 3.1)。
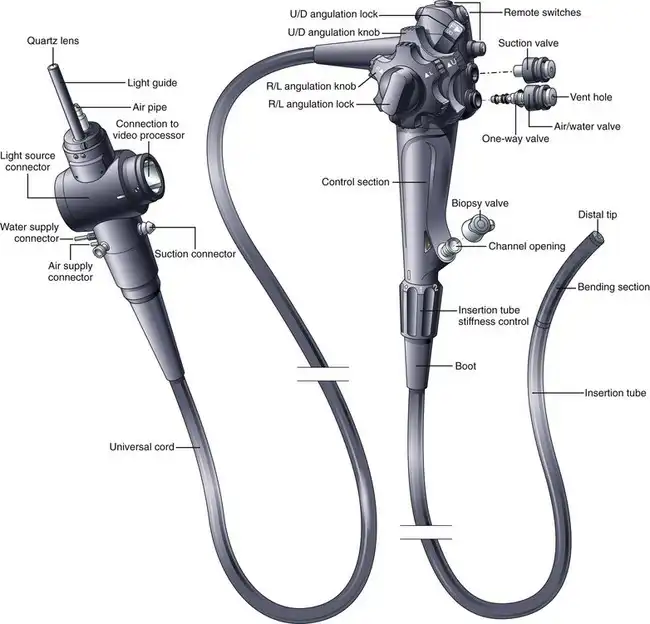
图 3.1 标准柔性电子内窥镜的基本组成部分。
该仪器设计用于内镜医师用左手握持和操作。一些医师用左手食指交替控制吸引阀和气/水阀,其余手指握住仪器。另一些医师则用左手食指控制吸引阀,中指控制气/水阀,无名指和小指握住仪器。上下角度调节旋钮由医师的左手拇指操作。左右角度调节旋钮可由左手拇指和前两指或右手控制。内镜医师的右手主要用于控制插入管——根据需要进行推、扭和拔操作。
内镜的插入管是胃肠内镜设计中的一个重要区别特征。尽管根据内镜的应用领域不同,其插入管也存在明显的差异(例如,肠镜的超长长度、经鼻食管镜的纤细程度),但不同型号内镜之间的细微差别同样重要。这一点在结肠镜中尤为突出;尽管内镜医师可能出于各种原因偏好使用特定的结肠镜型号,但器械的插入管特性很可能比其他任何因素都更能决定内镜医师的选择。如果说器械的任何单一规格能够决定内镜医师插入器械的速度和便捷程度,那便是插入管的机械特性。
内窥镜制造商投入了大量精力来改进插入管的结构并选择理想的材料。图 3.2 显示了典型结肠镜的内部组件。插入管通常包含:(1) 用于吸引(活检)、供气和供水的导管;(2) 通常还有一根用于向前喷射水流的导管;(3) 四根角度控制线;(4) 连接内窥镜远端电荷耦合器件 (CCD) 图像传感器和视频处理器的细电线;以及 (5) 用于将光源的光线传输到内窥镜远端的纤细玻璃纤维。具有可调节插入管柔韧性的结肠镜还有一个额外的组件——用于控制插入管刚度的张紧线。十二指肠镜还有一个贯穿插入管长度的额外线圈鞘,用于控制钳式提升器的上下位置(详见后文讨论)。内窥镜设计师的任务是在尽可能小的空间内容纳所有这些独立组件,同时还要保证各组件在器械使用过程中扭转和弯曲时能够自由活动,而不会损坏较为脆弱的部件(例如CCD线、光纤)。所有内部组件都会涂抹干粉状润滑剂,以减少插入管操作过程中各组件之间的相互应力。
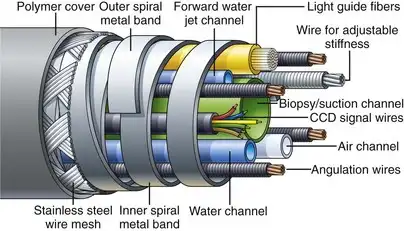
图 3.2 可变刚度结肠镜的内部组件。
如前所述,插入管的操作特性至关重要,尤其对于结肠镜而言。为了便于插入,器械必须能够精确传递内镜医师施加的所有细微动作和扭矩。内镜医师施加在轴杆近端的任何旋转(扭矩)都必须以 1:1 的比例传递到器械的远端,但当器械呈环状时,这种传递能力会丧失。插入管皮下设有扁平的螺旋金属带(见图 3.2),这有助于器械的扭矩传递。由于这些金属带的缠绕方向相反,因此在扭转插入管时,它们会相互锁定,从而将插入管一端的旋转精确传递到另一端。同时,这些螺旋带之间的间隙允许轴杆自由弯曲。这些金属带也赋予插入管圆形。它们的刚性可以防止插入管的内部组件被外力压碎。这些螺旋带上覆盖着细密的钢丝,钢丝编织成管状网状结构。一层塑料聚合物层(通常为黑色,结肠镜上为深绿色)挤压覆盖在该金属丝网上,形成插入管光滑的外表面。该聚合物层为插入管提供无创、生物相容且防水的表面。通常,聚合物层上会标有数字,用于指示插入深度。
经验表明,对于检查上消化道固定的解剖结构,较硬的插入管是最佳选择。而结肠由于其迂曲且袢活动度较大,最好使用较软的器械进行检查。该器械应具有足够的柔韧性(非刚性),以便轻松贴合患者迂曲的解剖结构,并尽可能减少对结肠壁和系膜的损伤。此外,该器械还应具有足够的柱强度,以防止在推动器械近端时发生弯曲。除了柔韧性之外,结肠镜还应具有足够的弹性,以便在回拉时能够恢复原状;这有助于取出肠袢。
获得最佳的柔韧性、弹性、柱强度和扭转能力组合是插入管设计的艺术和科学。改进其中一项特性通常会对其他一项或多项特性产生负面影响。最终设计通常是这些理想特性之间的一种折衷方案,并经过数月的临床试验验证。为了进一步改善插入效果,胃镜和结肠镜插入管的柔韧性通常具有端到端的变化。如图 3.3 所示,结肠镜插入管远端 40 厘米的柔韧性明显高于近端。这种柔韧性的变化是通过改变管外聚合物层的配方来实现的,该聚合物层在制造过程中挤出到金属丝网上。如图 3.4 所示,挤出机包含两种树脂,一种比另一种硬得多。最初,当插入管的远端通过机器时,一层软树脂被涂覆在远端 40 厘米的金属丝网上。在靠近管中部的过渡区,这种软树脂逐渐被硬树脂取代。插入管的近端部分(50 至 160 厘米)仅由硬树脂制成。最终得到的插入管具有柔软的远端部分,可以无创地穿过迂曲的结肠,而较硬的近端部分可以有效防止结肠镜已经拉直的结肠部分再次发生肠袢。
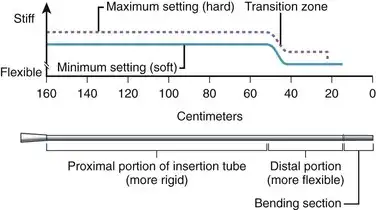
图 3.3 插入管刚度的图形表示。注意其变化——远端 40 厘米处更柔软。注意器械处于“硬”设置(虚线)时比处于“软”设置(实线)时更硬。
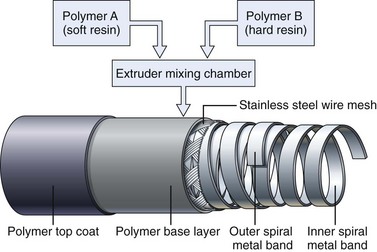
图 3.4 插入管盖的组成。
临床经验表明,内镜医师对于理想的插入管应具备哪些特性常常存在分歧。这种分歧可能源于培训、插入技术或既往经验的差异。此外,一些内镜医师希望在手术过程中根据插入深度或患者的解剖结构来调整插入管的特性,这促使了可调节刚度插入管的研发。
可调节刚度的结肠镜在插入管内设有一根贯穿整个长度的张紧钢丝(见图3.2)。该钢丝的张力大小通过旋转插入管近端、控制部分下方的一个环来控制(图3.5)。当该张紧系统中的拉线处于“软”位置时,除了金属丝网和聚合物涂层提供的刚度外,该张紧系统不会为插入管提供额外的刚度。如图3.5所示,当控制环旋转到“硬”位置时,控制环上的一个斜槽会拉动拉线末端的滑销,拉伸拉线并使其处于较大的张力下。这种张力会使包裹拉线的螺旋钢丝变硬,从而显著增加插入管的刚度。如图3.3所示,虽然插入管的基底刚度是通过改变聚合物基底层中硬树脂和软树脂的混合比例来设定的,但在手术过程中,可以通过旋转刚度控制环来进一步增加插入管的刚度。这种可变刚度机制并非贯穿插入管的整个长度,因此不会影响内窥镜的远端部分。
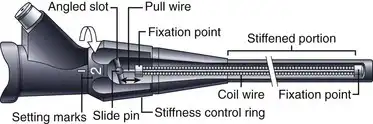
图 3.5 可变刚度结肠镜的刚度调节机制。
图 3.6 展示了典型末端观察内窥镜(例如胃镜或结肠镜)远端部分的组成部件。远端部分较大的圆形玻璃透镜是物镜。该透镜将胃肠道黏膜的微缩图像聚焦在固态 CCD 图像传感器的表面上。图像传感器通过一组极细的导线将连续的图像流发送回视频处理器。物镜和 CCD 单元紧密密封,以防止冷凝水导致图像模糊,并保护成像系统免受意外液体进入仪器造成的损坏。用于照亮体内的光线通过光纤照明穿过仪器。该光线通过导光透镜系统均匀地分散到内窥镜的视野中。
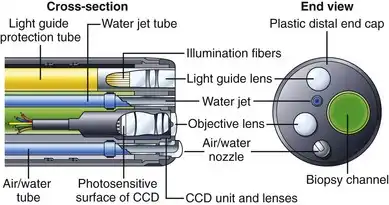
图 3.6 结肠镜远端尖端组件。
有些内窥镜只有一个照明系统(如图 3.6 所示)。其他型号的内窥镜则配备两束光纤和两个导光透镜,以改善活检钳(例如圈套器)两侧的照明,并便于将各种组件放置在插入管内。用于活检和吸引的通道出口靠近远端物镜。活检通道相对于物镜的位置决定了附件进入视野时在图像中的显示方式。在某些器械上,圈套器或活检钳看起来像是从图像的右下角发出的;而在另一些器械上,这些附件则从左下角进入视野,以此类推。在计划诸如分块息肉切除术或止血术等复杂操作时,内窥镜医师必须清楚附件将进入视野的哪个位置。
插入管内还包含一些细管,用于输送空气和水(见图3.2)。这些细管通常在距离远端几英寸处汇合成一根单管(见图3.9)。这根气水合管连接到器械顶端的气水喷嘴。在内镜医师的控制下,可以向物镜喷水进行清洁,也可以从喷嘴喷气对胃肠道进行充气。一些胃镜和结肠镜在远端还配备一根额外的水管和一个水射流喷嘴,用于冲洗黏膜上的碎屑(见图3.6)。
图 3.7 展示了典型十二指肠镜远端内部的组件。图 3.7A 为十二指肠镜远端光学和照明系统的示意性横截面图。用于观察组织的物镜现在位于远端侧面,而不是位于仪器的顶端。棱镜用于将视角偏转 90 至 105 度,从而将仪器转换为侧视内窥镜。照明光纤同样在仪器顶端呈陡峭弯曲,使光线从侧面发出。与端视内窥镜一样,位于物镜附近的空气/水喷嘴会先用水冲洗物镜以进行清洁,然后用空气吹走残留的水滴。该喷嘴喷出的空气还用于给患者充气。所有十二指肠镜都配有镊子提升器,用于主动偏转通过通道的任何附件的顶端。提升器机构如图 3.7B 所示。该升降器通常位于内镜顶端(下位)的凹槽内。当内镜医师希望将附件提升到视野中时,他/她会操作仪器控制部分上的拇指控制杆(图中未显示)。该拇指控制杆会拉动升降器导丝,将升降器从凹槽中提升到上位,从而使附件顶端向上偏转至视野中。在某些仪器中,例如V-scope(奥林巴斯公司),该升降器带有一个小凹槽,用于固定一根0.035英寸的导丝,以便在更换附件时帮助稳定导丝。
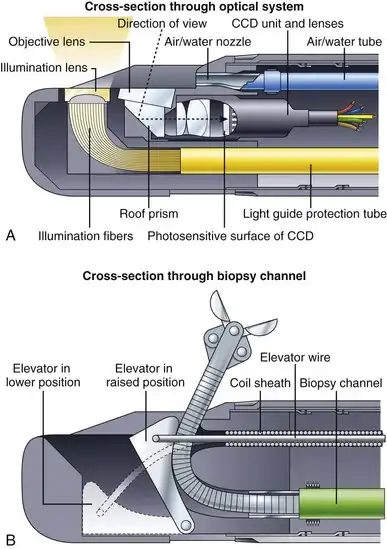
图 3.7 A 和 B,十二指肠镜远端尖端组件。
内镜插入管的远端也可由内镜医师操控。可弯曲部分,即弯曲段,其结构与插入管的其余部分不同。如图 3.8 所示,弯曲段由一系列形状奇特的金属环组成,每个环通过一个可自由活动的关节与其两侧的环相连。这些关节由一系列枢轴销构成,每个枢轴销与其相邻的枢轴销错位 90 度。一组枢轴销使弯曲段能够上下弯曲,另一组枢轴销使弯曲段能够左右弯曲。两组枢轴销共同作用,使弯曲段能够向任意方向弯曲。弯曲方向由贯穿插入管长度的四根角度调节钢丝控制(见图 3.2)。这四根导线分别牢固地连接在弯曲段的顶端,位置分别为3点钟、6点钟、9点钟和12点钟。拉动连接在12点钟位置的导线,弯曲段会向上弯曲,实现内镜医师所说的“顶端向上偏转”。拉动连接在3点钟位置的导线,顶端会向右偏转。拉动另外两根导线,顶端则会向下偏转并向左偏转。内镜医师可以通过旋转上下或左右角度调节旋钮,依次拉动每根导线。(为简化起见,图3.8仅展示了上下角度调节系统。)同时旋转上下和左右角度调节旋钮,可以实现顶端的联合运动(例如,向上偏转并向右偏转),使内镜医师能够将内镜顶端向任意方向移动。
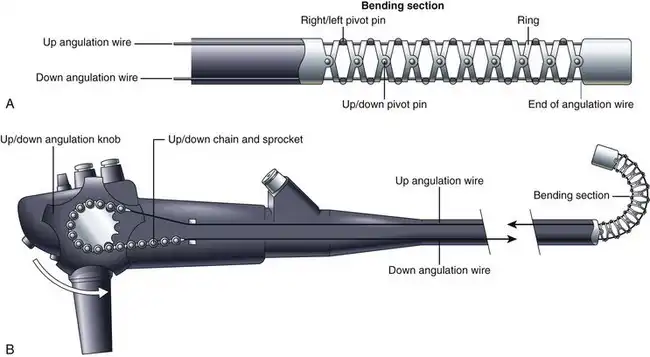
图 3.8 A,弯曲段的结构。B,旋转角度旋钮导致弯曲段发生挠曲。
图 3.9 展示了一个典型的内镜空气、水和抽吸系统的示意图。光源内的气泵向从内镜光源接口伸出的管道提供微压空气。该空气通过气道(导管)输送到控制部分的空气/水阀。如果该阀门未被覆盖,空气会直接从阀门顶部的通气孔排出(见图 3.1)。该通气孔允许气泵在不需要空气时自由抽气,从而减少泵的磨损。如果内镜医师需要对患者进行充气,则用指尖覆盖通气孔;这会封闭通气孔,迫使空气沿气道向下流动,并通过远端喷嘴排出。空气/水阀的阀杆内装有一个单向阀(见图 3.1),用于在检查期间将空气留在患者体内。在内镜检查过程中,通常会对胃肠道进行充气,使其压力略高于大气压。如果没有系统中的这个单向阀,当操作者将手指从阀门上移开时,来自受检器官的空气就会回流到远端喷嘴,沿着插入管内的气道向上流动,并从气/水阀上的孔流出。防回流阀对于维持患者气腹至关重要。
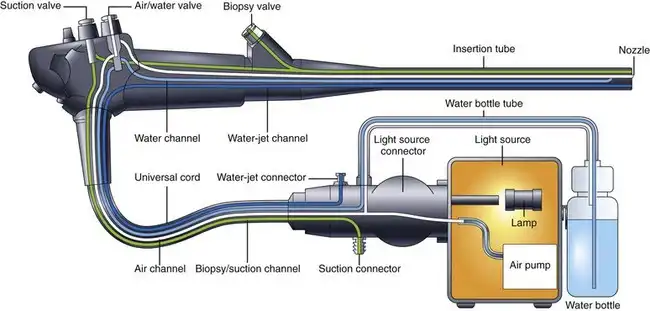
图 3.9 空气、水和吸气系统的配置。
手术过程中用于清洁物镜的水储存在连接于光源或推车上的水瓶中(见图 3.9)。气泵除了提供充气空气外,还会对水瓶加压,将水从瓶中挤出并送入内窥镜。水通过水瓶盖上的导管输送到内窥镜的光源接口,然后经由水通道沿通用连接线向上到达气水阀。当内窥镜医师按下气水阀时,水继续沿插入管内的水通道向下流动,并从远端喷嘴流出。喷嘴将水流喷射到物镜表面,从而清洁物镜。
内镜控制部分上的阀门也控制着抽吸。抽吸源(可以是医院的壁挂式抽吸系统或便携式抽吸泵)连接到内镜的光源接口。当内镜医师按下抽吸阀时,抽吸作用会施加到插入管内的抽吸/活检通道。内镜远端存在的任何液体(或空气)都会被吸入抽吸收集系统。通道开启阀(也称为活检阀)会关闭活检通道的近端开口,防止空气被吸入抽吸收集系统。
如图 3.9 所示,空气、水和抽吸系统的设计中包含多项固有的安全特性。供气系统没有活动部件,也没有可能卡在持续“开启”位置的机械阀门,从而避免意外过度充气。空气会直接从阀门上的排气孔排出,除非医生用手指堵住该开口。如果抽吸系统发生阻塞,内镜医师难以控制过度充气,只需迅速将所有阀门从内镜上移除即可。此操作会停止空气和水的输送,使患者的胃肠道压力通过打开的阀门气缸释放。
内窥镜利用非相干光纤束将光从外部光源传输到内窥镜的远端。该光纤束由数千根细如发丝的玻璃纤维(直径30微米)组成,这些纤维表面涂有光学涂层,用于将光限制在纤维内部,并通过一种称为全内反射的现象实现光的端到端传输。光线从光纤的一端进入后,会在光纤壁上反射数千次,然后从光纤的另一端射出。用于制造光纤纤芯和包层的玻璃类型以及纤芯和包层的厚度都经过精心选择,以使光纤束能够传输尽可能多的光(有关光纤的更完整讨论,请参阅Kawahara和Ichikawa的著作)。
内窥镜光源通常使用300瓦氙弧灯来产生电子内窥镜检查所需的强白光。这些灯也会产生大量热量。光源内部的散热器、红外滤光片和强制风冷系统可防止内窥镜的光纤束过热和烧毁。仔细观察内窥镜光导的顶端,可以看到一个耐烧石英透镜,它用于收集光源灯发出的光线并将其导入内窥镜(见图3.1)。在内窥镜的另一端,位于仪器远端的导光透镜将光线均匀地扩散到视野中(见图3.6)。光源中一个自动控制的光圈(光阑)控制着从内窥镜顶端发出的光强度。
当内窥镜位于胃等较大的腔体内,需要充足光线时,光源的光圈会打开,使内窥镜能够传输最大光线。当内窥镜尖端非常靠近黏膜,光线充足时,光源的光圈会自动关闭,以减少光源发出的光量。如果光线太弱,监视器上的视频图像会显得昏暗且颗粒感强。如果光线太强,监视器上的图像会泛白(即出现“光晕”)。视频处理器通过精确控制光源的光量,自动将照明亮度保持在CCD图像传感器可接受的范围内。
电子内窥镜中使用的图像传感器通常被称为CCD。这些传感器是由硅半导体材料制成的固态成像器件。传感器表面的硅对光敏感。当一个光子照射到CCD的光敏表面时,它会使表面硅原子中的一个电子脱离束缚。硅材料中会产生一个带负电的自由电子,同时在硅晶体结构中原本电子束缚的位置上产生一个带正电的空穴。这种现象被称为光电效应,如图3.10所示。当更多的光子照射到传感器表面时,会产生更多的自由电子和相应的空穴。传感器中积累的电荷量与照射到CCD上的光量成正比。此外,无论照射到传感器上的光是什么颜色,都会产生这些电荷。
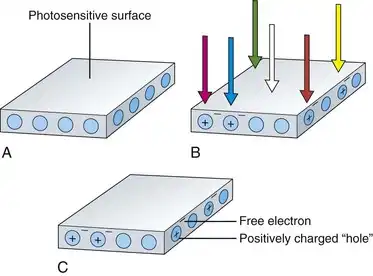
图 3.10 光电效应。A,光敏表面。B,光子照射到表面后释放电子,在材料内部产生电荷积累。C,光照结束后,电荷仍然存在。
虽然单个感光元件可用于测量照射到物体表面的光亮度(例如在光度计中),但它无法再现图像。要再现图像,必须将感光表面分割成数千个独立的小光点矩阵。当图像聚焦在这种传感器的表面上时,图像在矩阵中每个光点的亮度都会被自动测量。通过了解图像中每个点的亮度,视觉系统就能精确地再现图像。CCD 是这种固态视觉系统的常用组件。CCD 图像传感器的表面被分割成一个矩形阵列,阵列中的离散光点被称为像素或像元。图 3.11 展示了一个具有这种阵列的 CCD 传感器。在电子内窥镜中,CCD 位于仪器的远端,就在物镜的正后方(如图 3.6 所示)。物镜将观察的黏膜的微缩图像直接聚焦到该传感器的表面上。由于之前所述的光电效应,照射到CCD上的光图案(即图像)会立即转换为存储的电荷阵列。由于每个像素中存储的电荷与相邻像素相互隔离,因此传感器能够忠实地将光学图像转换为其电信号副本。
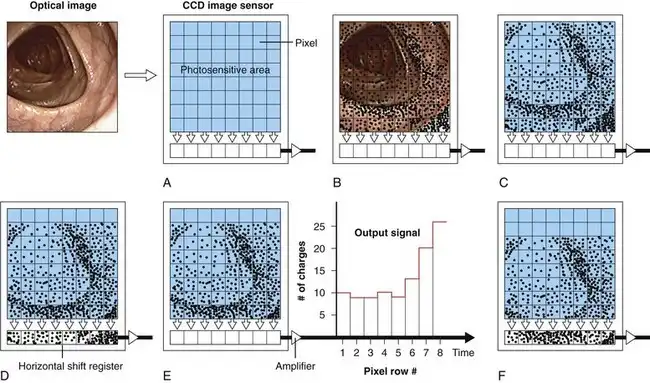
图 3.11 使用线传输电荷耦合器件 (CCD) 进行图像采集和读取。虽然实际的内窥镜 CCD 包含数十万个像素,但为简化起见,图中所示的阵列包含 64 个像素,排列成 8 行 × 8 列的矩阵。A,黏膜图像投射到 CCD 的光敏表面上。B,由于光电效应,图像的电副本得以生成。C,遮光后,电副本仍然存在。D,副本向下移动一行,将底行的数据推入水平移位寄存器。E,移位寄存器清空,产生输出信号。F,副本再次向下移动一行。该过程重复进行。
这种电信号经过处理后被发送到视频监视器进行显示。如图 3.11 所示,图像中暗区域的像素由于产生的电荷较少而产生较低的电压。图像中亮区域的像素由于产生的电子/空穴对较多而产生相对较高的电压。每个像素的电荷量取决于入射光的亮度,可以在某个最小值到某个最大值之间变化。光能到电荷的转换过程是线性的。照射到像素上的光子数加倍,像素产生的电荷量也会加倍,直到光敏单元的存储容量达到饱和。
CCD曝光图像后,必须按顺序“读出”CCD中产生的电荷,并进行处理以重现原始光学图像。电荷在CCD内部的移动方式取决于CCD的结构。三种最常见的CCD类型是线转移CCD、帧转移CCD和隔行转移CCD。每种CCD类型在以下方面各有优势:CCD对光的灵敏度(即内窥镜照明系统所需的亮度)、所需的光源类型(频闪或非频闪)、CCD尺寸(影响内窥镜远端尺寸)以及电荷从CCD转移出来的速度。图3.11所示的CCD示意图为线转移CCD。图3.11A展示了光学图像在CCD感光表面上的投影。在短暂暴露于图像后,阵列中的每个光敏像素点都会产生电荷(图 3.11B 和 C)。为简化起见,图 3.11 仅展示了一个像素数量极少、产生的电荷量也极少的阵列。这些电荷用光敏像素点内的小点表示。
每个像素内的电荷通过与每个光敏像素相邻的电极(图 3.11 中未显示这些电极)进行控制,并在 CCD 表面上移动。通过改变施加在这些电极上的电压,各个像素内的电子以电荷包的形式从一个像素转移到另一个像素。这些电极上的电压连续变化使电荷向 CCD 的底部边缘移动,并进入水平移位寄存器(参见图 3.11D)。水平移位寄存器中的电荷经过输出放大器并转换为输出信号。输出信号的波动与每个像素中存储的电荷数量成正比。在图 3.11E 所示的过程中,原始图像底部一行的电荷已被读取,并通过输出放大器发送到视频处理器进行重建。整个图像的电信号表示在 CCD 上向下移动了一行。水平移位寄存器读出并清空后,阵列中每个像素的电荷会依次向下转移到其下方的像素,从而导致图像副本的第二次移位。如图 3.11F 所示,此转移过程会将原本位于阵列倒数第二行的电荷填充到水平移位寄存器中。水平移位寄存器中的电荷再次被读出,从而产生一个输出信号,该信号代表原始图像倒数第二行的亮度。
图像副本的处理以类似的逐步方式继续进行,直至整个CCD被读出。CCD读出并清空后,即可进行下一次曝光。电荷耦合过程——即电荷以数据包的形式在像素间传输——赋予了CCD(电荷耦合器件)这一名称。CCD最远端角落的电荷会依次经过数百个光敏像素,最终到达水平移位寄存器。在目前的电子内窥镜中,CCD每秒要进行60到90次曝光、读出和重新曝光。为了在这些重复传输过程中保持图像的保真度,必须确保这些电荷包在CCD读出过程中保持完整,电荷量在每秒数十万次的传输过程中不能有损失或增加。线传输CCD的光敏阵列必须在图像移动和读出的整个过程中(如图3.11C及后续步骤所示)完全避光。这种屏蔽是必要的,它可以防止正在传输的图像信息与仍然照射在感光元件上的光线产生的新电荷混合。为了保持原始图像的完整性,在读取图像副本时,感光元件必须完全处于黑暗状态。在内窥镜应用中,一种方法是在读取CCD时对内窥镜发出的光线进行频闪,即短暂中断光线;这会产生一个瞬间的闪光来照射图像传感器,随后是短暂的黑暗期,以便读取和清除CCD。使用过红、绿、蓝(RGB)顺序内窥镜系统(通常称为黑白CCD系统)的内窥镜医师都熟悉频闪内窥镜光源的概念。
尽管频闪视频系统在内窥镜检查中应用广泛,但它们存在一些缺点,尤其是在运动的平滑再现方面。一种替代采用频闪光源的线转移CCD的方案是采用连续(非频闪)光源的隔行转移CCD。如图3.12所示,隔行转移CCD在每列光敏元件旁边都设有一系列垂直移位寄存器。光照后,光敏元件上产生的电荷会立即快速转移到相邻的垂直移位寄存器。由于电荷能够快速一步转移到垂直移位寄存器,因此在读出过程中无需中断CCD的照明。同时,垂直移位寄存器中的电荷会逐步转移到水平移位寄存器,并在那里以常规方式读出。 (图 3.12 中的红色箭头表示左上角像素中产生的电荷的读取路径。)垂直移位寄存器被屏蔽,使其在 CCD 持续曝光时能够被清空。在读取第一幅图像的同时,CCD 会采集第二幅图像。当垂直移位寄存器最终清空后,传感器阵列中新生成的图像副本会立即从像素点传输到垂直移位寄存器,然后该过程重复进行。
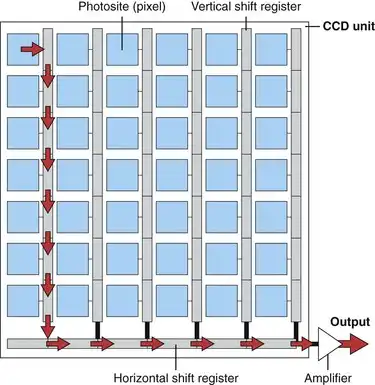
图 3.12 线间传输电荷耦合器件 (CCD) 的示意图。
隔行传输CCD的一大优势在于它无需频闪照明。由于整个传感器阵列一次性清空至垂直移位寄存器,因此传感器阵列可以立即准备好捕获下一幅图像。使用连续、非频闪光源的所谓彩色芯片内窥镜就是隔行传输CCD系统的例子。
图像分辨率是内窥镜图像质量的关键组成部分。分辨率通常使用类似于图 3.13 所示的测试方法进行测量。将一张由清晰印刷的黑白线条组成的测试图放置在距离内窥镜尖端一定距离处。该测试图包含一系列间距逐渐缩小的线条。仔细观察内窥镜视频监视器上显示的测试图图像(图 3.13C)。间距较大的线条可以清晰地分辨为单独的线条对。然而,间距较小的线条通常会模糊不清,无法识别为单独的线条。
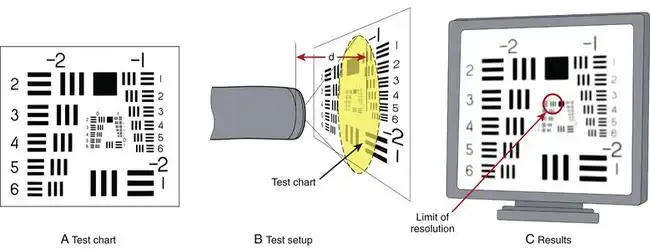
图 3.13 分辨率量化测试装置。
内窥镜的分辨率极限定义为在图像变得模糊到线条完全融合之前,仍能分辨出最近线对的距离。随着测试图靠近内窥镜尖端,测试图的图像放大倍数增加,内窥镜能够分辨出越来越小的线对。图 3.14 展示了内窥镜分辨率随距离变化的典型曲线。随着内窥镜越来越靠近测试图,内窥镜能够分辨出越来越细的线对,直到 A 点达到其最大分辨率。此时,内窥镜也处于最近聚焦点。由于焦距损失增加,将测试图靠近内窥镜会导致图像质量下降。受图像模糊的限制,图 3.14 所示的典型标准结肠镜的工作范围为 7 至 200 毫米(如图中紫色实线所示)。
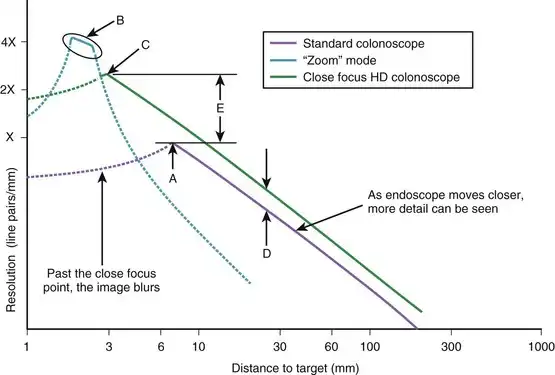
图 3.14 标准结肠镜、变焦结肠镜和近焦结肠镜的分辨率。
市面上有一些电子内窥镜具备光学变焦功能。这些内窥镜通常在镜身上设有控制旋钮,用于调节远端镜头,以便在内窥镜非常靠近目标组织时获得清晰的图像。如图 3.14 所示,这些内窥镜能够分辨比标准内窥镜小四倍的线对;这是通过使内窥镜在距离组织仅几毫米处聚焦来实现的。然而,这种分辨率提升四倍是有代价的。与显微镜类似,这些仪器的景深非常有限,通常在 1 到 2 毫米之间。如果内窥镜距离组织过近或过远,图像会迅速失焦,图像质量下降。如图 3.14B 中的蓝色实线所示,变焦内窥镜在“变焦”模式下的工作范围非常有限,并且很难保持对焦。
近年来,近距离聚焦高清(HD)内窥镜的问世使其在诸多方面优于标准内窥镜和光学变焦内窥镜。总体而言,高清内窥镜的分辨率更高,因为其图像传感器的像素数量比标准内窥镜更多(见图3.14D)。此外,近距离聚焦内窥镜的光学系统使其能够在失焦前更近距离地观察目标组织。如图3.14所示,近距离聚焦高清结肠镜能够在失焦前接近测试图3毫米,其分辨率是标准结肠镜的三倍(图3.14E)。尽管其分辨率仍低于光学变焦结肠镜,但这款近距离聚焦结肠镜拥有非常宽广的景深(3至200毫米,如图中绿色实线所示),使其使用起来与任何标准内窥镜一样便捷。
前文对变焦内窥镜的讨论指的是具有光学变焦功能的内窥镜。这与大多数电子内窥镜所配备的电子变焦功能不同。电子变焦并不会提高内窥镜的实际分辨率。电子变焦只是将CCD中央部分捕获的信息放大显示在显示器上。电子变焦不会向显示器图像添加任何新的图像信息,也不会改变内窥镜在上述测试中测得的分辨率。光学变焦则能显著增加图像细节,因为内窥镜能够更近距离地接近组织,从而获得真正的放大图像。
所有固态图像传感器本质上都是单色器件,只能再现黑白图像。CCD表面的硅光电探测器产生的电荷量仅与照射到阵列上的光强度(亮度)成正比。简单的图像传感器无法区分入射光的颜色。如图3.10所示,红光光子和蓝光光子产生的电荷量相同。为了使内窥镜能够再现必要的颜色属性,系统必须具备额外的手段来分析照射到传感器上的光的颜色(波长)。
人们发现,人眼能够感知的几乎所有颜色都可以通过混合红、绿、蓝(RGB)三种颜色的光来匹配。如果三个投影仪分别配备RGB滤光片,并且投影的光束相互重叠,则最终得到的图像类似于图3.15所示。红色和绿色投影仪重叠产生的颜色与单色黄光无法区分。同样,绿色和蓝色投影仪重叠产生的光会产生纯青色的视觉感受。红色和蓝色重叠则产生品红色。令人惊讶的是,当三个投影仪的光束在中心重叠时,观察者会看到一片纯白色区域,完全看不到任何三种组成颜色的痕迹。如果能够精确控制并调节每个投影仪的强度,就可以在重叠区域的中心位置重现几乎任何光谱颜色。
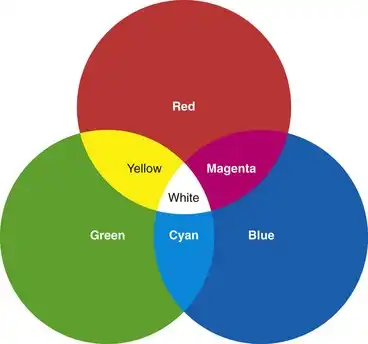
图 3.15 加色原色的示意图。
所有视频图像均使用 RGB 三原色重建。由于这三种颜色可以加色组合以模拟所有其他光谱颜色,因此它们通常被称为三原色。这三种颜色(RGB)是用于在视频监视器屏幕上创建全彩图像的荧光粉的颜色(图 3.16)。黄色 (Ye)、青色 (Cy) 和品红色 (Mg) 在视频成像中也发挥着重要作用,被称为互补色。目前,商用电子内窥镜使用两种不同的颜色重建系统。第一款商用视频图像内窥镜是 Welch Allyn 公司于 1983 年推出的 VideoEndoscope,它基于 RGB 顺序成像系统。许多当前的仪器仍然使用该系统。第二种系统,即所谓的彩色芯片内窥镜,现在已成为全球主流系统。每种颜色重建系统都有其自身的优缺点,将在后文详述。
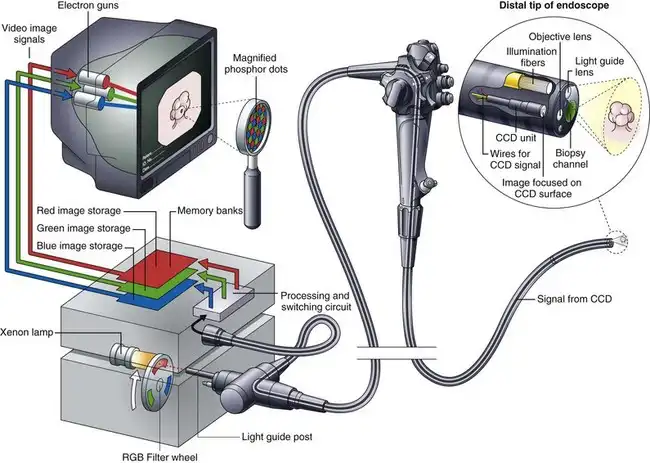
图 3.16 红色、绿色和蓝色 (RGB) 顺序内窥镜成像系统示意图。
图 3.16 示意性地展示了 RGB 顺序电子内窥镜系统的组成部分。内窥镜的远端安装有一个单色(黑白)CCD。位于内窥镜顶端的物镜将内窥镜视野的微缩图像聚焦到该 CCD 的光敏表面上。该图像通过贯穿内窥镜的光纤束进行照明。该光纤束将光源内的灯发出的光传输到内窥镜的远端。与光纤内窥镜或彩色芯片内窥镜所用的光源不同,这种光不是连续的,而是频闪或脉冲光。光源内的高强度氙灯发出色温接近日光的连续白光。一个带有三个彩色光段(RGB)的旋转滤光轮位于该灯和内窥镜的光导柱之间。这个滤光轮将照射到导光管束上的光线切割并着色成红、黑(无光)、绿、黑、蓝、黑交替的脉冲光。从内窥镜远端观察时,肉眼看到的照明是闪烁的白光,而不是实际的RGB顺序脉冲光。滤光轮以每秒20到30转的速度旋转,这三种原色混合在一起,肉眼观察时呈现白色照明。
这种独特的照明系统的目的是生成三幅独立的单色图像,每幅图像都是在视野依次被三种原色光照射时获得的。在红色滤光片位于光路中的极短时间内,胃肠道黏膜仅被红光照射。CCD图像传感器捕捉到黏膜在红光照射下的单色(黑白)图像(图3.17)。天然呈红色的组织在红光下反射强烈,呈现明亮状态。红色较少的组织区域反射红光较弱,在红光照射下呈现暗色。在红光照射下获得黏膜的单色图像后,滤光片轮旋转到相邻的不透明区域。此时,内窥镜照明短暂熄灭,CCD上的图像被读取,经过处理和切换电路后,存储在视频处理器的“红色图像”存储器中(见图3.16)。红色图像存储完毕后,滤光轮旋转,将绿色滤光片置于光路中。CCD 读取到绿色光照射下黏膜的单色图像(见图 3.17)。该图像被读出并发送到视频处理器,存储在“绿色图像”存储器中。类似地,当滤光轮旋转到蓝色区域时,会获得第三幅单色图像。该图像相应地存储在“蓝色图像”存储器中。这套针对三种原色的图像采集过程每秒重复 20 到 30 次——具体速度取决于视频处理器的规格。同步电路使滤光轮的旋转与 CCD 的读出同步,并控制切换电路,将每幅新图像定向到相应的存储器。
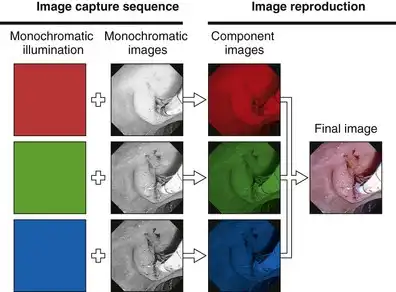
图 3.17 使用红色、绿色和蓝色 (RGB) 顺序照明进行图像采集。
作为RGB顺序成像系统的替代方案,一些电子内窥镜采用彩色芯片成像系统。彩色芯片CCD本质上是一个黑白图像传感器,其表面粘合了一个定制的多色微滤光片。该滤光片使CCD能够直接且同时分辨图像的各个颜色分量。为了强调所有三个颜色分量都是由单个“芯片”(即CCD)同时获得的,有时也用“瞬时单板CCD”来指代这种器件。如图3.18所示,彩色芯片CCD中常用的是一种彩色马赛克滤光片。马赛克滤光片可以设计出无数种不同的颜色配置;然而,图3.18所示的颜色组合非常常见。该马赛克滤光片使用的颜色为黄色、青色、品红色和绿色(Ye/Cy/Mg/G)。这些色块以2×2像素的方格图案排列,并在CCD表面规则重复。
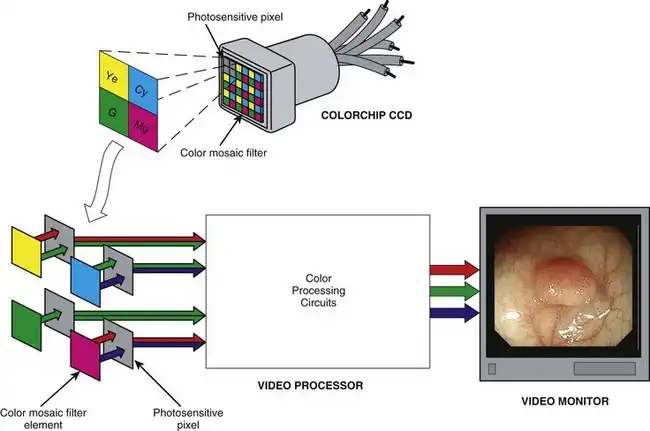
图 3.18 彩色马赛克滤光片与彩色芯片电荷耦合器件 (CCD) 中的像素相匹配,使图像传感器能够同时捕获投射到其感光表面上的图像的全部颜色信息。
由于发送到视频监视器的最终输出信号必须是标准的RGB分量图像,因此在显示之前,必须将Ye/Cy/Mg/G滤光片后产生的图像转换为其主要的RGB分量。这种转换是通过对相邻像素的信息进行加减运算来实现的,直到计算出传感器中每个像素的特定RGB值。如图3.19所示,黄色滤光片吸收蓝光,但允许红光和绿光通过;这使得所有黄色滤光片后面的像素都能接收到红色和绿色信息。图3.19还显示,青色滤光片后面的像素接收到光谱中的蓝色和绿色部分。品红色像素接收到红色和蓝色信息。在一个典型的由四个Ye/Cy/Mg/G像素组成的像素块中,两个像素接收到红色信息,三个像素接收到绿色信息,两个像素接收到蓝色信息(参见图3.18)。
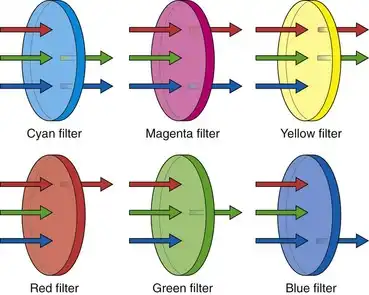
图 3.19 滤光片颜色对红、绿、蓝 (RGB) 光透射率的影响。
通过在视频处理器中使用适当的算法对相邻像素的信息进行加减运算,可以推导出每个 Ye/Cy/Mg/G 像素块的各个 RGB 分量值。蓝色分量值可以通过从青色像素产生的电荷数中减去绿色像素产生的电荷数来确定(B = Cy − G 或 B = [B+G] − G)。红色分量值可以通过从黄色像素产生的电荷数中减去绿色像素产生的电荷数来确定(R = Ye − G 或 R = [R+G] − G)。对整个 CCD 表面上的所有 2 × 2 像素块重复进行此类计算。完成此过程后,矩阵中每个像素块所需的所有 RGB 分量值都将被计算出来。有人可能会问,既然使用原色 RGB 滤镜覆盖像素可以直接得到 RGB 分量值而无需计算,为什么还要使用由互补色(Ye、Cy 和 Mg)组成的马赛克滤镜并采用处理算法呢?答案在于 Ye/Cy/Mg/G 马赛克滤镜在亮度方面比 RGB 马赛克滤镜具有显著优势。
当使用RGB滤光片时,每个像素都经过过滤,仅接收三种原色中的一种(见图3.19)。青色滤光片过滤后的像素会同时接收到蓝光和绿光,其亮度高于纯蓝色或纯绿色像素。同样,黄色滤光片(红+绿)或品红色滤光片(蓝+红)过滤后的像素接收到的光子(光)也比纯RGB滤光片过滤后的像素更多。由于通过Ye/Cy/Mg/G马赛克滤光片的光强度增加,采用这种结构的CCD具有更高的光敏度。互补色马赛克滤光片的显著优势在于,由于其更高的光敏度,这些滤光片允许内窥镜设计者使用更小的光导光纤束来构建内窥镜,从而最大化内窥镜的视角并增加景深。所有这些特性都能提升性能,但都需要额外的光。因此,所有商用彩色芯片内窥镜都使用互补色马赛克CCD。
彩色芯片电子内窥镜在运动再现方面比RGB顺序电子内窥镜具有固有优势。RGB视频处理器中的滤光轮通常以每秒20到30转的速度旋转。由于每个颜色分量图像都是按顺序单独采集的,因此( 1/30 使用30转/秒的滤光轮)采集构成单个视频图像的三个分量图像需要几秒钟的时间。如果内窥镜和被观察物体之间存在相对运动(这在内窥镜检查中经常发生),则三个分量图像在物体的大小和位置上可能会略有不同。当这三个RGB图像随后叠加在视频监视器上时,它们很可能出现错位。如果内窥镜医师在物体快速移动时碰巧暂停图像,这种错位将清晰可见。虽然RGB顺序电子内窥镜难以再现运动,但彩色芯片电子内窥镜在成像运动组织方面表现出色,因为它同时采集图像的所有三个颜色分量。由于照明是连续的、非频闪的,并且帧速率与当代电视标准一致,因此使用彩色芯片视频示波器再现动态图像流畅自然。
彩色芯片电子内窥镜的另一独特优势在于其能够缩短有效快门速度,从而提高所拍摄图像的清晰度。彩色芯片系统通常每秒拍摄一张新的视频图像 1/60。虽然这个时间间隔相对较短,但由于拍摄期间物体运动,快速移动的物体在被定格时可能会出现轻微模糊(但不会呈现色彩分离)。为了减少这种模糊,将电子拍摄周期缩短到正常时间的几分之一(例如,从 1/60 每秒一次缩短到 1/250 每秒一次)是有益的。与传统胶片摄影类似,曝光时间越短,物体越清晰,但为了防止曝光不足,必须对物体进行更明亮的照明。许多彩色芯片内窥镜配备的快速快门模式可能无法为远距离全景图像提供足够的光线,但在真正需要的情况下,快速快门拍摄模式能够非常有效地生成明亮、清晰的定格图像(例如,快速移动的黏膜的特写静止图像)。
与RGB顺序成像系统相比,彩色芯片电子内窥镜具有多项固有优势(表3.1)。前文已讨论的优势包括:(1) 能够流畅自然地再现运动;(2) 静止图像上不会出现颜色分离;(3) 快速快门模式可防止即使是快速移动的物体也出现图像模糊。其他优势包括:(4) 兼容标准(非频闪)氙灯光源;(5) 增强透照效果;(6) 在激光治疗过程中表现更佳。对于RGB顺序成像内窥镜而言,腹部透照存在问题,因为其频闪光输出远弱于非频闪系统。许多RGB顺序成像光源都配备了在“透照”模式下暂时移除光路中旋转滤光轮的装置。这样可以产生稳定、强烈的白光,非常适合透照。然而,一旦移除滤光轮,图像就会丢失,因为在大多数情况下,光照强度过高会导致CCD饱和,从而产生几乎全白的图像。即使可以看到图像,也是黑白的,因为滤光轮必须处于正确的位置才能再现颜色。
表3.1 电子内窥镜成像系统的优点和缺点
| 优势 | 缺点 |
|---|---|
| 色卡系统 | |
| 流畅、自然地再现运动 | 难以适应色彩分析研究 |
| 拍摄的图像没有颜色分离。 | |
| 即使拍摄对象在移动,高速快门模式也能防止图像模糊。 | |
| 使用标准(非频闪)氙灯光源 | |
| 在正常观察条件下,透照现象是可能发生的。 | |
| 激光治疗期间表现优异 | |
| RGB序列系统 | |
| 可获得高分辨率图像 | RGB分量图像之间的图像滑动 |
| 每个像素都代表所有三种颜色。 | 快速运动物体上的“彩虹效应” |
| 通过更换滤光片,可以实现更高级的颜色分析。 | 需要频闪光源 |
| 激光治疗会受到白色瞄准光束和图像“光晕”的阻碍。 | |
| 透射照明法需要移除滤光轮,并生成黑白图像。 | |
RGB,即红、绿、蓝。
RGB顺序电子内窥镜的一大优势在于其更高的分辨率。图像分辨率很大程度上取决于原始图像的像素数量。传统的彩色芯片系统需要多个像素的信息,并通过算法处理这些信息,才能获得图像中每个点的RGB分量值。在RGB系统中,每个像素依次被RGB光照射。每个像素依次提供三个颜色分量的信息。单个像素即可提供所有三个颜色分量这一特性,对于内窥镜等小型成像设备而言是一项优势。实际上,对于大多数电子内窥镜而言,这一优势并不显著,但当需要尽可能细的内窥镜时(例如,胆道内窥镜),这一优势就显得尤为重要。由于RGB顺序电子内窥镜使用原色滤光片,并且颜色分量在视频处理器中被分离、采集和分别处理,因此这类内窥镜能够提供非常精确的颜色信息。这种潜在优势在常规内窥镜检查中通常并不明显;然而,在图像分析研究中,RGB顺序系统优于彩色芯片系统。
近年来,奥林巴斯(日本东京)推出了一种名为窄带成像(NBI)的新型观察模式的内窥镜系统。该功能旨在通过选择性地操控血红蛋白的成像,增强对黏膜表面细节(例如凹陷模式)的观察,并提高微血管结构与周围组织之间的对比度。血红蛋白是组织中的主要发色团。图3.20显示了氧合血红蛋白在可见光谱范围内的相对吸光度。吸收峰值出现在415 nm(蓝光)处。在540 nm附近观察到第二个吸收峰(绿光)。从图3.20可以明显看出,血红蛋白反射而非吸收红光,这赋予了血红蛋白其特征颜色。利用血红蛋白的特征吸光度信息,可以设计一种成像系统,该系统能够根据内窥镜检查组织中血红蛋白的相对存在与否来提高图像对比度。
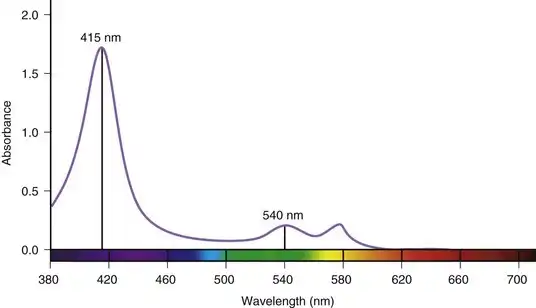
图 3.20 氧合血红蛋白的吸收光谱。
图 3.21 以示意图的形式展示了 RGB 顺序电子内窥镜系统中 NBI 成像的实现方式。其光源与图 3.16 所示的标准内窥镜系统相同,均采用氙灯和旋转式 RGB 滤光轮。然而,为了进行 NBI 成像,在氙灯前方临时放置了一个特殊的 NBI 滤光片。该滤光片滤除氙灯产生的宽光谱白光(图 3.21 中的光谱 1),仅允许波长中心约为 415 nm 的极窄蓝光波段和波长中心约为 540 nm 的极窄绿光波段通过(图 3.21 中的光谱 2)。正是由于使用了窄波段(即波长非常有限的光)来照射组织,NBI 才得名。
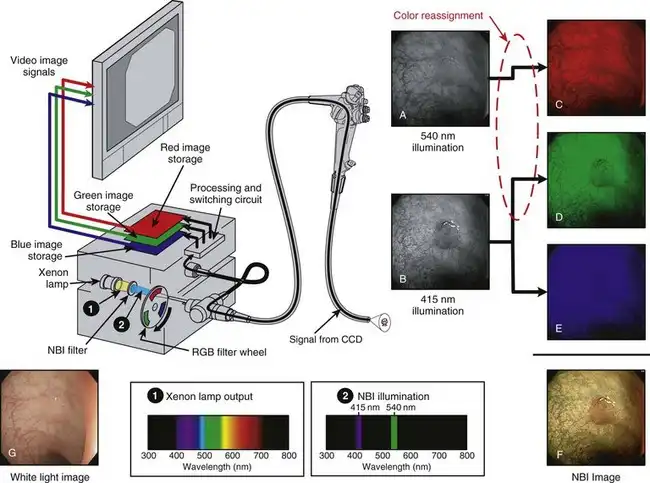
图 3.21 窄带成像 (NBI) 与红色、绿色和蓝色 (RGB) 顺序电子内窥镜系统。
(内窥镜图像由Y. Sano和S. Yoshida提供。)
RGB顺序窄带成像(NBI)系统的成像序列如下:当红色滤光片位于光路中时,由于NBI滤光片中不含红光,因此没有光线进入内窥镜。此时不生成图像,也不存储图像。滤光轮旋转至绿色滤光片。通过NBI滤光片的绿光(540 nm)也通过旋转滤光轮的绿色滤光片,穿过内窥镜,照射组织。(NBI滤光片发出的415 nm蓝光被旋转滤光轮中的绿色滤光片阻挡。)CCD捕获了组织在540 nm窄带绿光照射下的单色(黑白)图像(见图3.21A);然而,视频处理器切换电路并没有将该图像存储在预期的绿色图像存储器中,而是将其发送到空的红色图像存储器(见图3.21C)。这是有意重新分配颜色的操作。
最后,滤光轮旋转到蓝色滤光片段。该滤光片段允许来自NBI滤光片的415nm蓝光通过,组织被中心波长为415nm的窄光谱蓝光照射。CCD捕获黏膜在415nm照射下的黑白图像(见图3.21B),视频处理器按预期将该图像存储在蓝色存储器中(见图3.21E)。视频处理器还将该415nm图像的相同副本存储在绿色存储器中(见图3.21D),这是第二次有意重新分配颜色。此时,红色分量图像由组织在540nm窄带照射(绿光)下的图像构成,而绿色和蓝色分量图像则由组织反射415nm窄带照射光(蓝光)的图像构成。 RGB滤光轮旋转一周后,图像被分配到各个RGB图像存储区域,三个RGB分量图像同时发送到视频监视器,并在监视器上叠加(见图3.21CE),最终得到一幅全彩NBI图像(见图3.21F)。这幅最终的NBI图像与组织在正常白光照射下的图像(见图3.21G)截然不同。颜色重新分配改变了组织的自然颜色,并且仅使用氧合血红蛋白高度吸收的波长对组织进行选择性照明,显著增强了黏膜病变的表面纹理。
NBI技术也可应用于彩色芯片视频平台。图3.22展示了在彩色芯片内窥镜光源中插入NBI滤光片的过程。该NBI滤光片将氙灯发出的宽光谱白光(图3.22中的光谱1)过滤成与RGB顺序成像系统相同的NBI光谱。彩色芯片NBI照明采用415 nm和540 nm窄带光对组织进行连续、同步的照射。内窥镜中的彩色芯片CCD捕获在这种特殊NBI照明下反射的组织图像。图像捕获后,图像信息由视频处理器进行处理后显示。图3.23总结了彩色芯片NBI图像的处理过程。CCD上的彩色马赛克滤光片对图像进行过滤,如前所述。然而,由于NBI照明中不包含红色波长,因此没有红色图像信息进入视频处理器中的颜色处理电路——只有蓝色和绿色信息可用。与RGB顺序NBI系统类似,视频处理器会将绿色信息重新分配,以红色分量图像的形式显示。同样,蓝色信息会先显示为蓝色分量图像,然后被重新分配为绿色分量图像。当这些RGB分量图像按此定义同时显示在视频监视器上时,彩色芯片电子内窥镜系统即可显示与RGB顺序电子内窥镜系统类似的NBI图像。
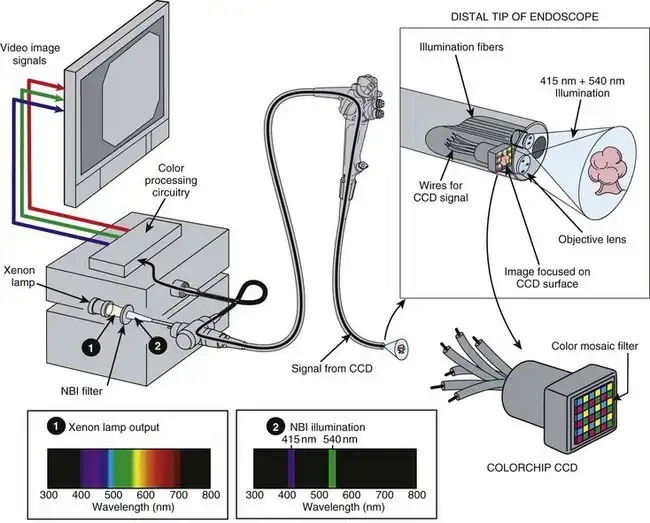
图 3.22 彩色芯片电子内窥镜系统的窄带成像 (NBI)。
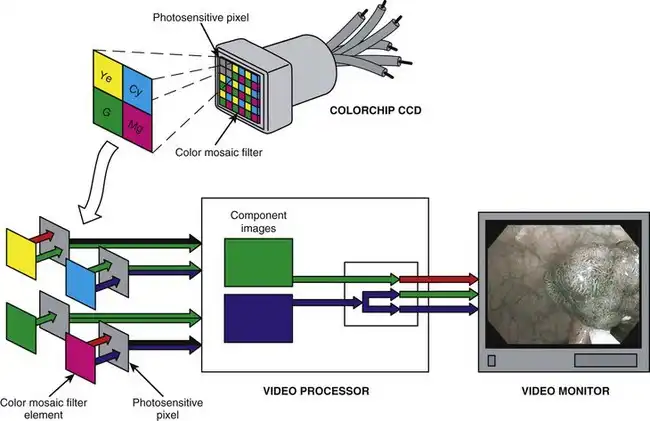
图 3.23 彩色芯片电子内窥镜系统的窄带成像 (NBI) 颜色处理。
两种系统的NBI功能均可通过内窥镜上的开关或视频处理器上的按钮轻松开启和关闭。内窥镜医师可根据需要快速切换标准白光成像和NBI成像模式。
所有视频处理器在处理过程中都会将内窥镜图像转换为数字格式。数字格式的图像很容易通过各种算法进行处理。一些常用的算法旨在产生不同程度的“边缘增强”或“纹理增强”。这些算法并非有意改变组织颜色,而是通过增加图像对比度来增强边缘清晰度或组织形貌。从某种意义上说,它们试图“锐化”图像。
近年来,人们致力于通过图像后处理来获取与窄带成像 (NBI) 类似的数据。富士(日本埼玉县)推出了名为 FICE(富士智能色彩增强)的功能,宾得(美国新泽西州蒙特维尔)推出了名为 i-Scan 的功能,这两项功能都旨在对内窥镜图像的颜色进行处理。这些后处理功能旨在增强黏膜血管和表面结构的显示。奥林巴斯的 NBI 功能通过在与血红蛋白自然吸收相对应的特定波长下照射组织来实现这一目标。FICE 和 i-Scan 使用普通白光照明,采集普通白光图像,然后对生成的普通内窥镜图像进行数字处理。这个过程有时被称为“最佳波段成像”或“多波段成像”。当内窥镜图像以数字形式存在时,可以轻松识别采集图像中每个点(像素)的特定颜色,并仅选择落在指定颜色范围内的像素。这些选定的颜色可以显示为新图像,可以进行处理以达到所需的增强效果,或者重新分配以显示为不同的颜色。
FICE系统允许用户从白光图像中选择特定的窄色域,并将其用作“最佳波段图像”。用户可以选择三个这样的最佳波段图像,并将其分配给RGB显示器的输入。FICE配置的处理器中预置了十个出厂预设的最佳波段;用户也可以自定义这些预设。60种估计波长(色调)中的任意一种都可以输入到三个RGB通道中的任意一个。内窥镜控制部分上的一个按钮允许操作员在传统白光成像和实时多波段成像之间切换。
用于组织诊断或鉴别的最佳多波段成像预设尚未确定;然而,其概念很容易理解。尽管内镜诊断通常是通过解读内镜图像中各种红色色调的细微变化来进行的,但使用包含鲜艳色彩的照片更容易展示后处理过程;图 3.24A 就是一张热气球升空的照片。一旦图像数字化,软件算法就可以轻松地从图像中选择并提取某些特定的色调。在图 3.24B 中,软件(Adobe Photoshop)选择了特定的蓝色范围和特定的绿色范围作为感兴趣的颜色。这个颜色范围可以非常窄(例如,某种深蓝色),也可以非常宽(例如,从浅蓝色到深蓝色)。这些选定的颜色可以按其正常显示方式呈现,也可以重新分配为不同的颜色以增强视觉效果。在图 3.24C 中,选定的蓝色被重新分配为绿色,选定的绿色被重新分配为蓝色。

图 3.24 图像处理示例。A,原始图像。B,选择具有蓝色和绿色色调的颜色。C,对所选颜色进行重新着色。
可以想象,数字后处理技术能够对图像进行处理的方式无穷无尽。然而,无论哪种方式,原始白光图像的颜色都会被改变。窄带成像(NBI)通过仅使用特定波长的光照射组织,从而改变组织中照明光与组织的相互作用,最终实现所需的对比度变化。在图3.24C所示的后处理示例中,虽然软件有效地交换了天空和草地的颜色,但也改变了场景中其他在白光图像中颜色相似的物体的颜色(例如,最高中心气球上的蓝色条带)。如果某些内窥镜结构,例如毛细血管、腺体和凹陷,始终具有独特的特征颜色,那么就可以设计一种软件算法来识别和增强它们。尽管目前还没有经过验证或标准化的图像处理方案用于常规临床应用,但研究人员仍在继续探索有价值的算法。
奥林巴斯于1984年推出了首款投入使用的超声内镜(EUS)仪器。最初的仪器(GF-UM2)是一款光纤内镜,其顶端装有机械扫描压电换能器。尽管基于视频的胃镜和结肠镜在20世纪80年代中期就已问世,但首款基于视频的EUS仪器直到1998年才问世。如今,视频成像技术也已成为EUS领域的主流技术。前文讨论的仪器整体结构、插入管组件、空气、水和吸引系统以及视频成像技术等内容,通常也适用于EUS仪器。除了这些系统之外,EUS仪器还必须包含用于超声波生成、耦合和检测的额外组件。
为了实现良好的声耦合,EUS仪器的顶端通常装有一个充满水的乳胶气囊。向该气囊内注入和排出水需要一条贯穿插入管长度的额外气囊充气通道,以及用于充气和排气的额外控制装置(特殊阀门)。EUS仪器采用机械扫描或电子扫描技术来生成超声图像。最早的EUS内镜使用单个压电换能器,该换能器绕着与内镜中心轴平行的轴线进行机械旋转(图3.25)。由此形成一个垂直于内镜轴线的360度径向超声图像平面,内镜本身位于图像中心。机械径向EUS内镜的工作频率通常为7.5至20 MHz,由于其图像平面方向方便且能生成高分辨率的EUS图像,在过去的二十年中,它们一直是主要的诊断性EUS仪器。
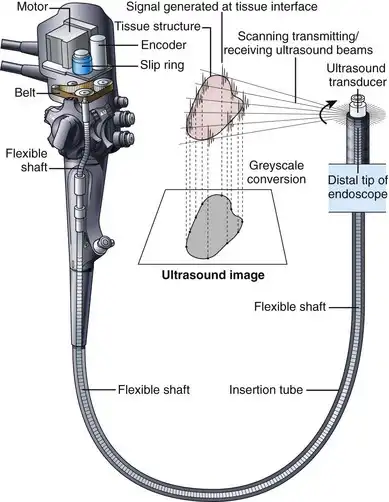
图 3.25 机械径向扫描内镜超声 (EUS) 仪器的示意图。
2003年,宾得公司推出了一款电子径向成像超声内镜。这是首款具备复杂超声功能(例如多普勒成像)的径向扫描仪器。然而,其成像范围仅限于270度扇形区域。随后,奥林巴斯公司推出了一款径向扫描超声内镜,该内镜采用360度全阵列压电换能器,取代了之前的单个机械旋转晶体(图3.26A)。宾得和奥林巴斯的电子径向扫描仪器现已取代了传统的机械扫描设计。20世纪90年代初,宾得公司推出了首款采用曲面换能器阵列的电子扫描超声内镜。该仪器可生成与内镜长轴对齐的图像平面,并且由于整个针尖都位于超声内镜图像平面内,因此首次实现了实用的细针穿刺活检(FNA)。与机械扫描仪器不同,电子扫描内窥镜具备彩色多普勒(显示血流方向和平均速度)和能量多普勒(提高测量血流速度的灵敏度,但无法提供血流方向信息)功能。曲面阵列内窥镜的视角(超声图像)通常为150°至180°,换能器频率为5至10 MHz。其光学观察方向为前斜方向,与细针穿刺针(FNA)的大致方向一致(图3.26B)。内窥镜远端尖端的升降器可使穿刺针上下移动,该升降器类似于十二指肠镜上的升降器,但活动范围较小。
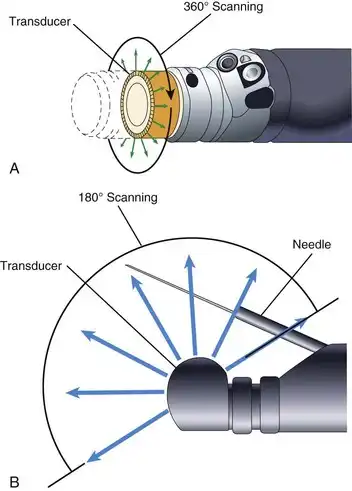
图 3.26 A,电子径向扫描内镜超声 (EUS) 内镜的远端。B,弯曲 EUS 细针穿刺 (FNA) 内镜的远端。
电子内窥镜是一种技术先进且复杂的临床工具。这类仪器刚上市时,各种市售型号的对比评测报告很常见。如今,随着电子内窥镜技术的成熟,此类技术对比评测报告已不多见,但市售型号的规格概要仍会定期发布。很难确定哪一项设计标准可以作为选择最适合特定临床应用的电子内窥镜的决定性因素。在评估电子内窥镜时,应考虑以下标准:
图像质量:该仪器是否具有足够宽广的视角、良好的景深、高图像分辨率、良好的图像对比度、准确的色彩、清晰的定格图像以及宽广的动态范围(能够在图像的亮部和暗部清晰地看到图像)?
照明特性:该仪器在所有临床条件下是否都具有足够的图像亮度?照明是否从图像中心到图像边缘均匀分布?系统是否能根据观察距离的变化自动调节亮度?
内窥镜基本功能:该仪器操作是否灵敏,插入管特性是否合适?其尖端角度是否平滑;控制部分的形状和重量是否合适;角度调节旋钮和阀门的位置是否方便;以及其吸力、充气和镜头清洗性能是否良好?
基本规格:制造商是否拥有全系列的仪器型号,具备各种插入管直径和活检通道容量,以满足所有临床需求?
适用于特殊治疗程序:电子内窥镜能否有效防止电外科发生器产生的图像噪声?使用激光时图像质量是否可以接受?
系统特性:视频处理器控制是否易于理解?用于控制远程设备的内窥镜开关是否易于操作?设备的尺寸和重量是否便于运输?
系统扩展和集成:该系统是否能够轻松地与硬拷贝设备、录像机和计算机化图像管理系统进行接口连接?
过去十年见证了胶囊内镜技术的飞速发展和临床应用。2000年,《自然》杂志发表了首批动物实验结果;2001年,文献中首次报道了胶囊内镜在不明原因消化道出血方面的临床试验。胶囊内镜是消化道微创检查发展趋势中的一项重大进展。目前,胶囊内镜系统由三个主要部分组成:(1)胶囊;(2)数据接收和存储系统;(3)图像查看和分析工作站。
美国食品药品监督管理局 (FDA) 于 2001 年 8 月批准的首个用于小肠观察的胶囊是 Given Imaging 公司(以色列约克尼姆)生产的 M2A 胶囊。该胶囊直径 11 毫米,长 26 毫米。胶囊及其组成部分如图 3.27 所示。胶囊一端有一个透明的光学圆顶,成像系统位于其后方。胶囊形状对称,体积小巧,可在肠道内滚动;它在穿过消化道时,以随机方式对近端或远端的黏膜进行成像。透明圆顶后方是一个非球面透镜,周围环绕着四个发光二极管 (LED)。该透镜将图像聚焦到互补金属氧化物半导体 (CMOS) 成像器上。成像器后方是两节氧化银电池,足以维持 LED、成像器和发射器至少 8 小时的运行。发射器和天线位于胶囊的后部。胶囊包装在磁铁旁边。将胶囊从磁铁上取下会触发开关,激活LED灯并开始图像传输。每秒拍摄并传输两幅图像,与闪烁的LED灯同步。由于肠道处于塌陷状态(即未注入空气),且观察的组织非常靠近光学穹顶,因此LED灯提供的少量光照足以满足要求。
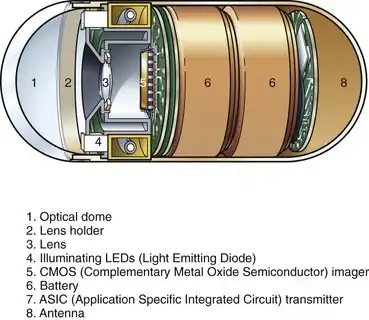
图 3.27 Given Imaging M2A 胶囊示意图。
(根据以色列约克尼姆Given Imaging公司的Pillcam产品重新绘制。)
Given Imaging公司推出了一款名为PillCamSB的升级版小肠胶囊内镜。奥林巴斯公司也推出了一款类似的小肠胶囊内镜,名为EndoCapsule。这三款胶囊内镜的尺寸完全相同。新款胶囊内镜的图像分辨率更高,视角更广,LED灯数量从四个增加到六个,工作站软件也得到了改进。部分系统还提供实时图像查看功能。奥林巴斯EndoCapsule采用CCD图像传感器,而Given Imaging胶囊内镜则采用CMOS图像传感器。在胶囊内镜检查过程中,患者腹前壁上会贴有八个传感器。这些传感器用于检测胶囊内镜发射的信号。通过测量不同传感器信号的相对强度,可以确定胶囊内镜在腹腔内的大致位置。工作站软件会在显示胶囊内镜图像的同时,显示胶囊内镜的运行路径。传感器导线连接到佩戴在腰带上的小型数据记录仪。该腰带装置相对轻便,不会对正常的非体力活动造成明显影响。患者可以自由活动,无需在检查记录阶段留在医院。检查结束后,传感器和束带将从患者身上移除。记录的数据下载到计算机工作站,工作站会将研究中约5万张图像转换成视频文件并存储在计算机硬盘上。研究人员可以在工作站屏幕上以预设速度观看该研究视频。
2004年,Given Imaging公司的PillCam ESO获得了FDA的批准,这是一种用于检查食管的双成像胶囊。目前,该胶囊已上市用于诊断巴雷特食管和食管静脉曲张。Given Imaging公司还在开发PillCam COLON,一种用于检查结肠的胶囊。多家公司正在研发使胶囊能够在胃肠道内主动推进的方法。胶囊的研发仍在继续。

